|
No
son muchos los años en que las explicaciones a un sin numero de
fenómenos fisiológicos encuentran su sitio en la biología molecular.
Desafortunadamente el incremento desmesurado de las enfermedades
crónicas modernas a provocado por fortuna un desarrollo importante
en esta área del conocimiento. Por muchos años el tejido adiposo
nunca fue considerado y hoy se saben aspectos impensados sobre el,
llegándolo a considerar como un importante órgano endocrino. El
tejido muscular por muchos años ha sufrido, por parte de la medicina
un abandono casi total, sin embargo hoy en el se encuentra el origen
directo o indirecto de múltiples alteraciones cardiovasculares y
metabólicas. No olvidemos que un infarto al miocardio es producto de
alteraciones en los lípidos y el gran responsable de su regulación
es el tejido muscular, no olvidemos que frecuencia cardiaca y
presión arterial se alteran mucho mas en sujetos con mala capacidad
funcional del tejido muscular que en aquellos que tienen una buena
capacidad de contracción y de trabajo de este tejido.
El
presente articulo desea introducir al lector a un dominio que con
seguridad será el mas citado por la literatura científica y pretende
comenzar a explicar cuales son los mecanismos intracelulares e
intramusculares que hacen que el ejercicio físico produzca acciones
especificas en las propias células musculares y células anexas, ya
que estas parecen ser la clave en la prevención y tratamiento de
múltiples enfermedades.
Estas adaptaciones metabólicas que ocurren en el músculo esquelético
a través del ejercicio físico involucran cambios en la expresión de
proteínas que guardan relación con el transporte de glucosa y su
respectivo metabolismo. Aproximadamente después de 16 horas de haber
efectuado el esfuerzo la expresión de una proteína, como por ejemplo
GLUT4 se incrementa en dos veces, permitiendo de esta forma una
restitución de los depósitos de glucógeno utilizados y permitiendo
un transpaso de la glucosa plasmatica al músculo.
Este simple fenómeno implica la fosforilacion de muchas proteínas
quinasa que directa o indirectamente provoca modificaciones en la
sensibilidad a la insulina, proceso que da origen a múltiples
síndromes metabólicos que aquejan a la sociedad actual. De esta
forma el ejercicio físico que permite una alta expresión de
adaptación o plástica de este tejido estaría contribuyendo a la
prevención y al tratamiento de enfermedades graves como la diabetes
tipo II, no insulino dependiente.
Finalmente estos procesos se asocian a una hipertrofia compensatoria
del tejido muscular que incluye mecanismos de regulación celular,
como la transcripción, acumulación y translación de RNAm permitiendo
así la síntesis de proteínas funcionales y estructurales que en
definitiva hacen al tejido muscular mas capaz, mas eficiente y muy
efectivo en la regulación del equilibrio entre los substratos que se
encuentran en compartimientos intra y extra musculares. Al parecer
en este fenómeno se sientan las bases del rol del ejercicio físico
en la prevención y elevación de los niveles de salud.
Nota: Este trabajo ha sido producto de una revision efectuada por
Dalina Garcia Pan quien es titulada en Bioquimica de la Universidad
de Buenos Aires, especializada en Nutricion Clinica y que orienta
sus estudios hacia las ciencias de la actividad fisica bajo la
tutoria de Carlos Saavedra MSc.
Resumen
El
ejercicio físico es un importante estimulo para la regulación de
múltiples procesos metabólicos y transcripcionales en el músculo
esquelético. Por ejemplo, el ejercicio incrementa la captación de
glucosa, la perfusion capilar, la velocidad de síntesis de
glucógeno, la sensibilidad a la insulina, lleva a una remodelacion
estructural de las células y a una hipertrofia compensatoria.
El propósito de este articulo es incursionar sobre los mecanismos
intracelulares y las proteínas señal intracelulares que intervienen
y regulan estos eventos en el músculo esquelético.
Las proteínas señales son proteínas que se encuentran en el citosol
de la célula y se encargan de llevar la información desde la
superficie de la célula hasta el núcleo. Este mecanismo es gatillado
cuando algún ligando (ej. insulina) se une a su receptor presente en
la membrana plasmatica de la célula (ej. el receptor de insulina)
produciéndose la activación del receptor que es transmitida a modo
de cascada a través de las proteínas señal, una proteína señal
activa a otra y así sucesivamente hasta llegar a activar proteínas
reguladoras de genes en el núcleo (llamadas factores de
transcripción) y así provocar la transcripción del ADN a ARNm, con
la consiguiente síntesis de proteínas. La activación de estas
proteínas señal es mediante fosforilacion en distintos aminoácidos,
generalmente tirosina, serina o treonina..
Las proteínas señal mas destacables relacionadas con este tema, son
algunas MAP Kinasas: ERK1/2, p38 y JNK, (Las MAP kinasas son
“proteínas kinasa activadas por mitogenos”, un mitogeno es un
inductor de proliferación y diferenciación celular, por ejemplo
insulina, factores de crecimiento como IGF-1.) y otras proteínas
señal como AMP kinasa, Akt, GSK3 y p70S6K.
Estas regulan en parte, la captación de glucosa, síntesis de
glucógeno, transcripción y regulación genica, síntesis de proteínas
e hipertrofia muscular.
En
cuanto a los mecanismos intracelulares, el aumento en la
sensibilidad a la insulina post ejercicio, parece deberse a la
disminución en el contenido de glucógeno en la célula muscular y al
aumento en la perfusion capilar, asociados al ejercicio y no a un
incremento en la cascada de señalización de la insulina.
En algunas de las proteínas señal intracelulares, aplicando
distintos protocolos de entrenamiento con ejercicios de sobrecarga,
se evidencia que las involucradas en la respuesta molecular y
celular que llevan a la hipertrofia compensatoria, tienen un periodo
refractario, en el cual de no mediar reposo, no es posible que
cumplan con su función de manera eficiente. Lo que permitiría
manipular la variable intervalo entre carga y reposo, de modo de
obtener un entrenamiento mas eficiente.
Introducción
El
ejercicio físico es un importante estimulo para la regulación de
múltiples procesos metabólicos y transcripcionales en el músculo
esquelético. Por ejemplo, el ejercicio incrementa la captación de
glucosa, la perfusion capilar, la velocidad de síntesis de
glucógeno, la sensibilidad a la insulina, lleva a una remodelacion
estructural de las células y a una hipertrofia compensatoria.
Todos estos procesos ocurren en respuesta a modificaciones
producidas por el ejercicio en diversos fenómenos tanto autocrinos,
paracrinos y sistemicos, como cambios en la concentración de
substratos responsables de la producción de energía de la célula
muscular. Estos fenómenos a su vez juegan el rol de mensajeros en la
respuesta al ejercicio, y van a intervenir y regular múltiples
sistemas de transduccion de señales intracelulares en la
célula muscular, responsables de regular los diversos procesos
metabólicos y transcripcionales (transcripción del DNA a RNA y
consecuente síntesis de proteínas) en respuesta al ejercicio.
Algunos mensajeros en la
respuesta al ejercicio:
pH, ATP/ADP, Ca
Durante la contracción, las fibras musculares generan estímulos
mecánicos, lo que a su vez produce la liberación de numerosos
metabolitos. Esto se acompaña de cambios en la temperatura, el pH
intracelular , cambio en la relación ATP/ ADP, cambios en la
concentración intracelular del Ca y otros metabolitos que podrían
actuar como mensajeros en la regulación del funcionamiento celular
con el ejercicio.
El
Ca, regula numerosas proteínas intracelulares, incluyendo
calmodulina kinasa, proteína kinasa C (PKC) y calcineurina que son
importantes intermediarios en las señales de transduccion
intracelular. En la matriz extracelular que interacciona con las
células musculares mediante integrinas citoesqueletales también
experimenta cambios.
Respuestas autocrinas, paracrinas y sistemicas,
Los efectos del ejercicio físico en la regulación de los fenómenos
anabolicos y el metabolismo del músculo esquelético, están mediados
también a través de vías de señalización receptor-ligando. El
ejercicio causa potentes respuestas sistemicas, las que incluyen la
liberación, entre otras de catecolaminas y otras hormonas. Estas
activan receptores de la superficie celular específicos. Un buen
ejemplo de este tipo de mecanismo es el incremento en la liberación
de adrenalina que mediante la estimulación de receptores B
adrenergicos, lleva a la activación de Adenilato Ciclasa, con el
consiguiente incremento de AMPc y activación de PKA.
Los neurotransmisores relacionados con la calcitonina, el factor
neurotrofico ciliar y la neurogulina son ejemplos de mensajeros
extracelulares liberados por el nervio motor , los cuales pueden
también estimular cascadas de señales intracelulares.
La
contracción muscular puede también activar receptores a través de
mecanismos autocrinos y paracrinos. La elongacion muscular activa
vías de señalización intracelular por liberación de factores de
crecimiento en forma autocrina, por ej. en el miocito cardiaco
mediante angiotensina II. Uno de estos factores es IGF-1 (factor de
crecimiento semejante a la insulina) y FGF (factor de crecimiento de
fibroblastos), ambos se incrementan en la contracción muscular,
activando vías de señales por mecanismos autocrinos. Además en la
contracción muscular, también se libera NO (oxido nítrico) que
regula mecanismos, entre ellos el mas importante el de
vasodilatacion que esta mediados por GMPc.(un mensajero químico).
Como podemos ver, el ejercicio es un complejo estimulo que por medio
de diversos mensajeros, Ca, pH, temperatura, hormonas,
neurotransmisores, oxido nítrico, factores de crecimiento,
modificación en substratos energéticos, etc… los cuales van a
regular múltiples sistemas de transduccion de señales
intracelulares los que a su vez pueden actuar sobre numerosos
procesos transcripcionales y metabólicos dentro de la célula
muscular.
Proteínas señal intracelulares
MAP Kinasas
Las MAP Kinasas son proteínas quinasas activadas por mitogenos,
(un mitogeno es un inductor de proliferación y diferenciación
celular, por ejemplo insulina, factores de crecimiento como IGF-1)
que también son denominadas ERK o quinasas reguladas por señales
extracelulares. Estas MAP kinasas, son activadas por una gran
variedad de señales (insulina, factores de crecimiento, factores de
stress ambiental) y transmiten estas señales fosforilando numerosos
substratos, obteniéndose como resultante varios efectos biológicos.
Algunos de ellos son inducción de proliferación, diferenciación
celular, hipertrofia, inflamación, apoptosis, metabolismo de
carbohidratos y transcripción de genes. La activación de estas
proteínas, es mediada por receptores del tipo tirosina quinasa, como
el receptor de insulina o los receptores B adrenergicos, que activan
proteína G o proteína Ras, estas forman parte de la cascada de
señalización, previas a MAP kinasas.

MAP kinasas activadas por el ejercicio
El
ejercicio físico activa MAP kinasas: ERK ½, JNK y p38, las mismas
son proteínas señal de distintas cascadas de la familia MAP kinasas,
que son activadas por mecanismos aun no del todo claros, pero
independientes de la via tradicional receptor-ligando.
ERK ½, (kinasas activadas por señales extracelulares uno y dos)
ERK ½ son MAP Kinasas (ERK 1 y ERK 2), activadas por MAP Kinasa
Kinasa ½ (MEK 1 y MEK 2), que a su vez es activada por Raf1 que es
una MAP Kinasa Kinasa Kinasa (MAPKKK).
El
ejercicio y la contracción incrementan la actividad de MEK ½ y
Raf1, ambas están upstream (por encima, previo a) de ERK ½ . La
activación resultante de ERK ½ es de manera rápida y transitoria.
Downstream (por debajo, posterior a) de ERK ½ activadas por el
ejercicio han sido identificadas RSK2 (90-kDa ribosomal S6 kinase
2)y MSK ½ (mitogen and stress- activated protein kinase).
Se
ha estudiado el incremento de activación de ERK ½ en sujetos
ejercitados en bicicleta con una pierna sola, comparando con la
pierna contralateral como control, y se observo que la activación de
ERK ½ en respuesta al ejercicio es de manera local, es decir es un
fenómeno “tejido especifico”, mas que un efecto sistemico. Las
moléculas involucradas en esta estimulación tejido especifica
permanecen aun sin delucidar. Se sabe que la vía clásica mediante
Receptor tirosina kinasa, involucrando Shc, Grb2, IRS-1 puede
descartarse como señal upstream de esta regulación, ya que no se ha
observado fosforilacion ni incremento de estas proteínas cuando se
incrementa la actividad de ERK ½.
JNK,
(c-Jun NH2-terminal kinase)
Es
una MAP Kinasa, activada por las MAP Kinasa Kinasa 4 y 7, a su vez
activada por una MAP Kinasa Kinasa Kinasa.
Se
ha observado la activación de la cascada de señales JNK en humanos
en respuesta al ejercicio efectuado en bicicleta ergometrica, en
extensión de rodillas mediante contracción excéntrica y concéntrica
de cuadriceps y en pruebas de maratón.
La
activación de JNK por el ejercicio es sostenida, se mantiene durante
el ejercicio y esta asociada con la rápida inducción de genes
tempranos, como c-Fos y c-Jun, por interacción directa con estos
factores transcripcionales, regulando así la transcripción genica,
generándose posiblemente de esta forma, proteínas del tipo
estructural o funcional.p38,
Es
una MAP Kinasa, activada por MAK Kinasa Kinasa 3 y 6, a su vez
activada por otra MAP Kinasa Kinasa Kinasa.
Hay 3 isoformas a, b y d (alfa, beta y gamma). a y b se encuentran
en cualquier tejido, mientras que d es exclusiva del músculo
esquelético y es la isoforma mayormente regulada por el ejercicio
físico.
Se
ha observado un incremento en la activación de la cascada de señales
p38 en ejercicio ergometrico y en pruebas de maratón. Evidenciadose
que p38 esta involucrada en la regulación de la captación de glucosa
debida a la contracción del músculo esquelético, pero aun no están
claros los mecanismos por los que se activa p38 con el ejercicio.
La activación de estas MAP
Kinasas con el ejercicio podría estar comandada por mecanismos
sistemicos, autocrinos o paracrinos, así como cambios en el nivel de
substratos responsables de la producción de energía en la célula
muscular.
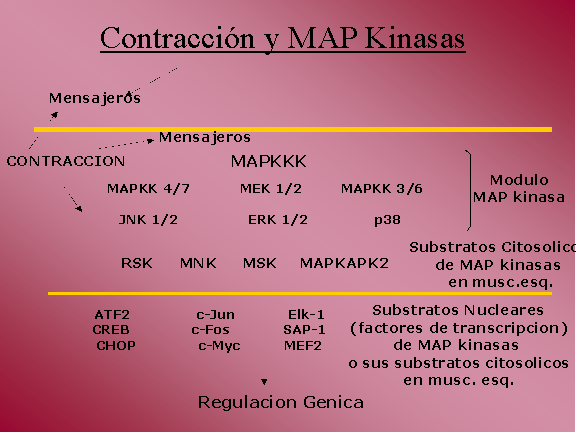
Los posibles substratos de estas
MAP Kinasas en el músculo esquelético, pueden encontrarse tanto en
el citosol como en el núcleo. A nivel citosolico se han
identificado: RSK (90-kDa ribosomal S6 kinase), MSK (mitogen and
stress- activated protien kinase), MNK (MAP kinase- interacting
kinase), todas ellas proteínas con actividad enzimática kinasa. A
nivel nuclear: ATF-2 (activating transcription factor 2), CHOP (CCAAT/enhancer-binding
homologous protein), CREB (AMPc-dependent response element-binding
protein), MEF2 (myocite enhancer-binding factor 2), c-Fos, c-Jun,
Elk-1, entre otros, todos ellos “factores transcripcionales”.
De este modo, vemos que la
activación de estas MAP Kinasas, puede llevar, por interacción
directa con factores transcripcionales o debido a la fosforilacion y
consiguiente activación de distintos substratos citosolicos, que por
translocacion al núcleo y fosforilacion de factores
transcripcionales, a la transcripción de genes como respuesta aguda
del músculo esquelético al ejercicio, y a largo plazo a adaptaciones
crónicas debidas a una regulación genica.
AMP kinasa
Es
una proteína señal básica en la regulación de múltiples procesos
metabólicos y anabolicos en el músculo esquelético.
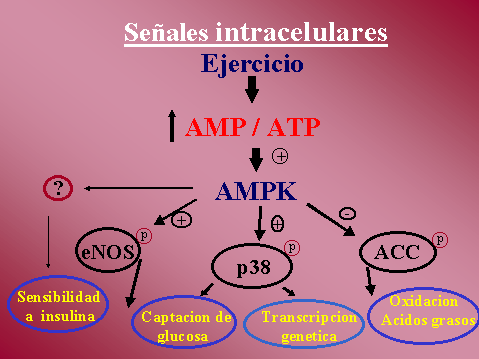
AMP kinasa detecta los niveles de
substratos energéticos en la célula. AMP kinasa es sensible a la
disminución de los depósitos de energía de la célula y provoca un
switch hacia vías de generación de ATP. La AMP kinasa es activada
por el incremento en la relación AMP / ATP y creatina fosfato.
Los substratos que son sensibles
a la acción de AMP kinasa en diversos tejidos incluyen: Acetil-CoA
Carboxilasa (ACC), 3-hidroxi-3metil glutaril CoA reductasa,
Glicerofosfato aciltransferasa, Oxido nitrico sintetasa endotelial (eNOS),
6-fosfo fructo 2-quinasa, lipasa hormono sensible y IRS-1.
La actividad contractil modifica
los niveles energéticos en el músculo esquelético y dependiendo de
la intensidad de la contracción puede haber una significativa
disminución en la concentración de ATP y de fosfo creatina. De este
modo, es decir, con las variaciones de nivel de estos substratos, el
ejercicio actúa como un estimulo fisiológico de AMP kinasa.
También, AMP kinasa interviene
como mediador del transporte de glucosa cuando este es estimulado
por la contracción. Esto se ha evidenciado en estudios realizados
con AICAR (5 amino imidazol 4 carboxamida ribonucleosido) que es
metabolizado por adenosina kinasa generando ZMP, un derivado
monofosforilado con efectos similares al AMP sobre la AMP kinasa.
AICAR puede estimular el transporte de glucosa en ausencia de
insulina, de manera similar al efecto de la contracción. este
transporte de glucosa es mediado por translocacion de GLUT 4 a la
membrana plasmatica desde el citosol.
Las moléculas downstream de AMP
kinasa que llevan a la regulación del transporte de glucosa
estimulado por contracción no se conocen aun, sin embargo hay
evidencias de que p38 es una de las proteínas señal
downstream de AMP kinasa involucrada en la regulación del transporte
de glucosa.
Esta bien establecido que la sensibilidad a la insulina para el
transporte de glucosa se incrementa luego del ejercicio en el
músculo esquelético. Uno de los posibles mecanismos moleculares
involucrados responsables de este incremento estaría relacionado con
la variación en el contenido de glucógeno en la célula muscular
luego del ejercicio, este mecanismo se detallara en párrafos
subsiguientes. Mientras que relacionado con la actividad de AMP
kinasa, se ha visto que la contracción, el tratamiento con AICAR y
la hipoxia, incrementan el transporte de glucosa estimulado por
insulina, esto sugiere que AMP kinasa podría ser una proteína clave
en los procesos de señalización que llevan al incremento en la
sensibilidad a la insulina post ejercicio.
AMP kinasa también interviene en la oxidación de ácidos grasos
estimulada por contracción. Tiene un rol importante en la regulación
de la oxidación de los ácidos grasos durante el ejercicio. Esto
ocurre a través de la fosforilacion de Acetil-CoA Carboxilasa (ACC)
por AMP kinasa, resultando en la inactivacion de ACC, que lleva a
una caída en los niveles de Malonil-CoA, deshinibiendo Carnitina
Palmitol Transferasa con el consecuente aumento del transporte de
ácidos grasos al interior de la mitocondria y favoreciendo así la
oxidación de ácidos grasos.
AMP kinasa también esta involucrada en la regulación genica, esto se
ha evidenciado por tratamiento con AICAR, con el que se observa un
incremento en la expresión de GLUT 4 y Hexoquinasa en fibras rojas y
blancas de múltiples músculos, por activación en la transcripción de
los genes correspondientes. Los mecanismos por los que AMP kinasa
modula la transcripción genica aun no están claros.
Proteínas Señal
mediadas por PI3-kinasa (fosfatidil inositol 3 kinasa)
La PI3-kinasa es una proteina
señal del inicio de la cascada de la insulina.
La contracción y la insulina
tienen efectos biológicos similares en el músculo esquelético, ambos
incrementan la captación de glucosa, de aminoácidos y la síntesis de
glucógeno.
Una hipótesis es que la insulina
y el ejercicio utilicen las mismas proteínas señal en la regulación
de esos eventos metabólicos. Sin embargo, el ejercicio o la
contracción muscular no incrementan la fosforilacion de tirosina ni
en el receptor de insulina ni en IRS-1, primeros eslabones en la
señalización de insulina.
Downstream de IRS en la vía de
señalización de insulina esta la enzima PI3-kinasa, que tampoco se
incrementan su activación con el ejercicio. La falta de activación
de estas moléculas es consistente con el hallazgo de que la insulina
y la contracción utilizan diferentes proteínas señal para producir
un incremento en la captación de glucosa y en la síntesis de
glucógeno en el músculo esquelético. Este incremento estaría
producido en la contracción a través de mecanismos independientes de
PI3-kinasa, y si involucra a Akt, GSK3 y p70S6K, todas ellas
downstream de PI3-kinasa.
Akt
Akt, proteína kinasa B. Akt es una serina/treonina kinasa que
es activada por una gran variedad de factores de crecimiento de
manera dependiente e independiente de PI3-kinasa.
Akt en el músculo esquelético
media muchos de los efectos celulares de la insulina, regulando el
crecimiento del músculo esquelético y su metabolismo.
En experiencias realizadas con
ratones, se ha observado un deterioro en el crecimiento con la
deficiencia de Akt1 y con la deficiencia de Akt2 en la reducción de
la captación de glucosa. Por otro lado, con técnicas de
sobreexpresion de Akt, mediante inyección de DNA, se manifiesta el
rol hipertrofico y de prevención de la atrofia muscular de Akt.
No esta claro si el ejercicio
activa Akt y la utiliza como proteína señal y genera controversia,
hay estudios que así lo afirman, y la encuentran relacionada con el
metabolismo de carbohidratos (interviniendo en la síntesis y
repleción del glucógeno), con el incremento en la sensibilidad a la
insulina por el ejercicio, en la regulación de la transcripción de
genes, y en la síntesis de proteínas e hipertrofia.
GSK3
GSK3, glucógeno sintetasa
kinasa 3. Es una serina treonina kinasa, primer upstream de la
enzima glucógeno sintetasa (GS), GSK3 fosforila e inactiva a GS, por
lo tanto tiene un rol importante en la regulación del metabolismo
energético, como así también en la regulación de la transcripción de
genes.El ejercicio inactiva a GSK3 de manera distinta a la insulina.
La insulina lo hace vía receptor de insulina (IR), IRS (Substrato
del receptor de insulina), PI3-kinasa (fosfatidil inositol 3 kinasa),
Akt, que fosforila a GSK3 en Serina 9 y 21 desactivándola, con lo
que GSK3 al ser inactivada no fosforila a GS, y como la GS es
activa cuando esta desfosforilada, la resultante será la
estimulación en la síntesis de glucógeno en respuesta a la insulina.
El ejercicio, también desactiva a
GSK3 en un grado similar al producido por la insulina, pero con la
diferencia de que no se observa fosforilacion en Serina 21. Esto
sugiere que el ejercicio regula la actividad de GSK3 en el músculo
esquelético de un modo alternativo. Algunos estudios realizados en
ciclistas muestran que luego de 60 minutos de actividad se
incrementa la fosforilacion en Ser 473 de Akt, esto podría explicar
la desactivacion de GSK3 por el ejercicio.
Las consecuencias fisiológicas de
la desactivacion de GSK3 con el ejercicio no se conocen exactamente,
una de las funciones es el incremento de actividad de GS, esta seria
una parte del mecanismo de regulación de GS. Es probable que GSK3
tenga una función en la regulación de procesos metabólicos y
transcripcionales. Se ha observado que GSK3 fosforila factores de
transcripción, muchos de los cuales están regulados por el
ejercicio.
P70S6K
Tiene un rol critico en la
regulación de la translación del RNA mensajero transcripto, es
decir, desde el núcleo hasta el citosol lugar donde se traduce a
proteínas. Bloqueando p70S6K se observa una significante inhibición
de la síntesis de proteínas en respuesta a la insulina.
Un set de ejercicio de sobrecarga
provoca un incremento en la síntesis de proteínas, mientras que con
el entrenamiento, a manera de adaptación crónica, aparece la
hipertrofia muscular. Como hipótesis esta regulación en la síntesis
de proteínas debida al ejercicio, podría estar mediada a través de
la activación de p70S6K en el músculo esquelético. Se ha observado
el incremento en la actividad de p70S6K luego de 6 hs. de
contracciones excéntricas máximas y este incremento en la actividad
de p70S6K también estaría estrechamente correlacionado con el cambio
en la masa muscular luego de 6 semanas de entrenamiento.
Como hemos visto el ejercicio
físico por medio de modificaciones en distintos parámetros, algunos
ya bien establecidos, regula múltiples señales intracelulares en el
músculo esquelético, estas, regulan distintas funciones celulares,
que se manifiestan como respuestas agudas frente a un único set de
ejercicio y como adaptación crónica frente al entrenamiento.
A continuación podemos ver un
cuadro esquemático de las señales intracelulares y sus efectos
sobre diversos fenómenos o mecanismos biológicos
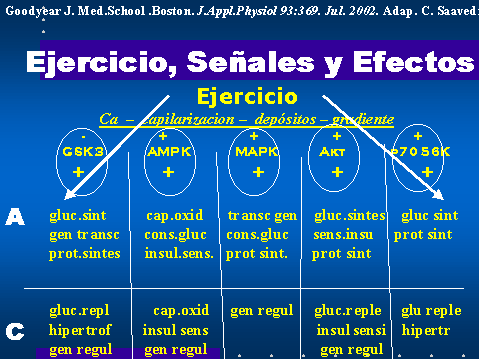
A= efectos agudos y C= efectos
crónicos
Señales intracelulares e
Insulino Resistencia
En
la diabetes tipo II, la insulino resistencia es causada por defectos
en el receptor y en las señales de transduccion de la insulina, en
IRS-1, y en la cascada de PI3K, esto se manifiesta en una reducida
estimulación del transporte de glucosa a través de la translocacion
de GLUT4 desde el citosol hacia la membrana plasmatica en las
células del músculo esquelético.
Como se detallo anteriormente la
insulina y la contracción muscular, estimulan la captación de
glucosa a través de GLUT4 por intermedio de proteínas señales
diferentes, y es posible que esta sea una de las razones por las
cuales el ejercicio fisico esta asociado a un mejoramiento en la
homeostasis de la glucosa y en la sensibilidad a la insulina. Esto
seria debido a que el entrenamiento físico lleva a modificaciones en
la expresión y actividad de proteínas clave involucradas en la
cascada de señalización de la insulina, manifestándose un incremento
en el transporte de glucosa en el músculo esquelético. Estos cambios
estarían relacionados con un incremento en la actividad de diversas
proteínas señal, como MAP kinasas, AMPK, Akt, que están asociadas en
parte con un incremento en la actividad transcripcional, con
consiguientes cambios en la síntesis de proteínas incluyendo GLUT4 .
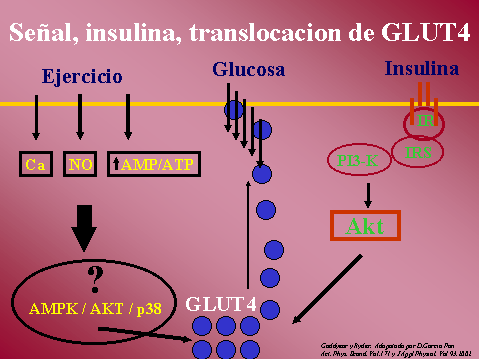
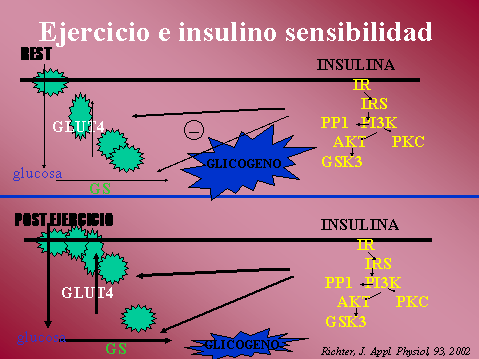
INSULINA, incremento de su
acción con el ejercicio.
La insulina tiene efectos en el
transporte de glucosa muscular y en la actividad de la glucógeno
sintetasa (GS). Facilita la síntesis de glucógeno a través de su
acción sobre ambos, en el transporte de glucosa, estimulando la
traslocacion de GLUT4 a la membrana y en la GS, estimulando su
actividad.
La translocacion de GLUT4
involucra al receptor de insulina (IR) y su correspondiente cascada
de señales, IRS-1, PI3K, Akt y PKC, como primeros eslabones en la
cascada de señales de la insulina y a la fosofolipasa D como lejano
eslabón adicional.
La actividad de GS es regulada
alotericamente por glucosa-6P y covalentemente mediante múltiples
fosforilaciones. La insulina incrementa la actividad de la enzima GS
por disminución en la fosforilacion de si misma. La cascada en que
PI3K esta involucrada en la regulación de GS a través de la
desactivacion de GSK3 y activación de PP1 (proteína fosfatasa 1)
permite la desfosforilacion de GS por consiguiente su activación.
Efectos del ejercicio en el transporte de glucosa y la actividad de
glucógeno sintetasa. (GS)
Se ha observado experimentalmente
mediante espectroscopia de RMN que la velocidad de síntesis de
glucógeno después de la deplecion de glucógeno postejercicio de baja
intensidad es realmente mas elevada que en el reposo. Eso es
probablemente porque la actividad de GS es también incrementada en
el ejercicio dinámico, el cual disminuye el contenido de glucógeno
en el músculo. Así vemos que la actividad de GS es mas elevada en la
deplecion de glucógeno comparada a cuando los depósitos están
completos en la célula muscular.
En estudios realizados con
roedores, se han observado modificaciones covalentes en GS y cambios
en su localización subcelular, aparentemente debidas a la presencia
de glucógeno. Con lo que la redistribución celular de GS inducida
por la deplecion de glucógeno, podría hacer que GS sea más
susceptible a la desfosforilacion por PP1 incrementándose así su
actividad.
Insulina, durante
el ejercicio.
En cuanto a la dependencia de
insulina para la captación de glucosa, en estudios in vitro, se
observo que durante la contracción muscular existiría una no
dependencia, resultando un efecto aditivo o potenciador del
ejercicio sobre insulina en la captación de glucosa. Mientras que in
vivo para lograr un efecto total del ejercicio sobre la captación de
glucosa, se hace necesario un nivel basal plasmatico de insulina. De
modo que con la deficiencia de insulina, la captación de glucosa
inducida por el ejercicio es menor que con niveles basales normales
de insulina.
La concentración plasmatica de
insulina disminuye hasta un 50 % durante el ejercicio, sin embargo
como la perfusion muscular se incrementa notablemente durante el
ejercicio comparado con el reposo, la concentración de insulina en
el músculo en ejercicio, se incrementa notablemente durante el
ejercicio. Esta podría ser la razón del aparente incremento de los
efectos de la insulina durante el ejercicio siendo esta la mitad del
valor que corresponde a concentraciones plasmaticas basales.
Insulina, postejercicio.
La sensibilidad a la insulina
postejercicio se ve incrementada, de modo que la velocidad de
síntesis de glucógeno es mayor, con lo se posibilita una rápida
repleción de los depósitos de glucógeno depletados por el ejercicio.
Este fenómeno primariamente
involucra un incremento en la acción metabólica de la insulina
post-ejercicio. También se ha observado que el ejercicio no siempre
incrementa la acción de la insulina, por ejemplo, inmediatamente
después del ejercicio, la acción de la insulina es disminuida por el
incremento en la concentración de catecolaminas y ácidos grasos
libres, así mismo, la contracción excéntrica disminuye
prolongadamente la acción de la insulina. Este fenómeno podría ser
por alteración en la expresión y función de determinadas proteínas.
Durante las primeras horas
post-ejercicio (3-4 hs), no se hallaron incrementos en la expresión
de GLUT4, en señales intracelulares ni en la actividad de GS en el
músculo humano. Pasado este tiempo, si se observa un incremento en
la expresión de GLUT4 por lo menos en roedores, aunque aun no ha
sido reportado en humanos. El hecho de que no se observen
modificaciones en las proteínas señal, podría deberse primeramente a
que no exista relación entre el incremento de estas señales y el
incremento de acción de la insulina, o a que las modificaciones sean
en la localización subcelular y los métodos utilizados en estos
estudios son en músculo lisado, (mezclado) con lo que se pierde de
investigar este tipo de modificación, o simplemente que la
sensibilidad de los métodos utilizados no sea la suficiente.
El incremento en la perfusion
capilar que ocurre durante el ejercicio, incrementa el delivery de
insulina y de glucosa, con lo que se incrementa la acción de la
insulina en el músculo y la captación de glucosa. Se ha observado
que si no se ingieren cantidades suficientes de carbohidratos luego
del ejercicio, los depósitos de glocogeno son reconstituidos
ligeramente y de manera incompleta. Esto es debido a que luego del
ejercicio se normaliza rápidamente la perfusion muscular, con lo que
vuelve el delivery de glucosa y insulina a niveles basales.
El nivel de los depósitos de
glucógeno en la célula muscular parece estar directamente
relacionado con la capacidad de la insulina de activar tanto el
transporte de glucosa, como la glucógeno sintetasa (GS).
En el músculo esquelético en
reposo, la insulina activa la síntesis de glucógeno por incremento
en la actividad de la GS y en la translocacion de GLUT4 hacia la
membrana, esto ocurre por medio de proteínas señal activadas o
desactivadas a partir de la unión de la insulina a su receptor. Por
mecanismos aun desconocidos el volumen de glucógeno produce una
regulación negativa sobre la acción de la insulina en ambos,
activación de GS y translucacion de GLUT4.
Con el ejercicio se depletan los
depósitos de glucógeno, por lo que la acción inhibitoria sobre la
acción de la insulina desaparece.
En cuanto a los mecanismos
moleculares involucrados, se observan cambios en algunas proteínas
de la vía de señalización de insulina, con la disminución de los
niveles de glucógeno hay activación de Akt y de AMPK. Hay evidencias
que muestran que no es necesaria la deplecion de glucógeno para que
haya un incremento en la acción de la insulina en el músculo, además
de que el incremento en la acción de insulina persiste aun cuando
los depósitos de glucógeno ya se hayan repletado.
Por lo tanto, las evidencias
sugieren que la deplecion de glucógeno postejercicio y el incremento
en la perfusion capilar son los factores que mas contribuyen en el
incremento en la sensibilidad a la insulina que se manifiesta con el
ejercicio.
Proteínas señal,
respuestas moleculares y celulares al ejercicio de sobrecarga
El entrenamiento con ejercicios
de sobrecarga induce respuestas moleculares y celulares necesarias
para producir una hipertrofia compensatoria.
Para su mejor comprensión se
detalla a continuación un estudio realizado por Haddad y Adams en
el Departamento de Fisiología y Biofísica de la Universidad de
California publicado en febrero del 2002 en el Journal of Apply
Physiology.
El estudio se realizo en ratas,
para el que fueron elegidos ejercicios isometricos de sobrecarga, ya
que la injuria en el músculo de la rata es mínima y en el humano
trae como consecuencia una hipertrofia muscular. La estimulación fue
eléctrica, consistió en 3 contracciones isometricas máximas por
minuto durante 30 minutos.
Se compararon las respuestas
celulares y moleculares obtenidas con dos protocolos distintos:
*Modelo un solo set de ejercicio:
Seis grupos de ratas (n=6 por
grupo).
30 minutos de ejercicio.
Fueron sacrificadas un grupo por
vez a distinto tiempo: 0, 2, 6, 12 y 24 hs. post-ejercicio.
Se recolecto el tejido y se
realizaron los ensayos que se detallaran mas adelante.
*Modelo dos sets de ejercicio:
Las ratas asignadas realizaron
dos sets consecutivos con distintos tiempos de intervalo de 8, 24 y
48 hs. entre los dos sets (3 grupos, n=18 cada grupo).
De cada grupo, 6 ratas fueran
sacrificadas a las 16hs., otras 6 ratas a las 24 hs. y otras 6 a las
40 hs. luego de finalizado el segundo set de ejercicio. Se recolecto
el tejido.
Análisis bioquímicos y moleculares
realizados:
Detección y cuantificion del RNAm
de distintas proteínas (IGF-1, su receptor IGFR-1, Ciclina D1 y
Miogenina entre otras) por medio de Transcripción Reversa, PCR
(reacción en cadena de la polimerasa) y Densitometria Laser.
Detección y cuantificacion de la
fosforilacion de proteínas señal intracelulares (p70-s6K y Erk-2)
por medio de inmunoblotting con anticuerpos específicos, SDS-page y
Western Blot.
Resultados obtenidos
Efectos sobre proteínas señal
intracelulares
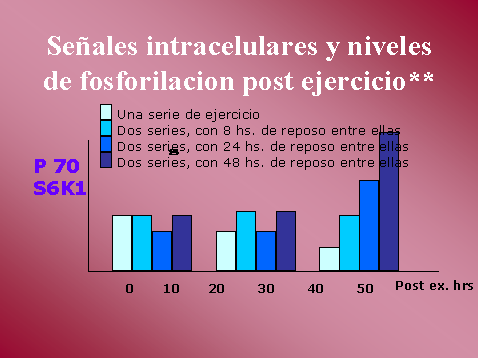
En el caso de p70-S6K (downstream
de PI3K) y ERK-2 (una MAP Kinasa), no se observan efectos sobre el
contenido total de proteína, con lo que no hay aumento en la
expresión de las mismas. Si se observa un incremento en la
activación de estas proteínas por fosforilacion, este incremento en
la fosforilacion podría ser resultado de un incremento en la unión
receptores a receptores de factores de crecimiento, incluyendo IGFR-1.
Como vimos anteriormente p70-S6K,
esta relacionada con una respuesta aguda frente a un único set de
ejercicio, como el del incremento en la síntesis de glucógeno y de
proteínas, y una adaptación crónica frente al entrenamiento, de
hipertrofia muscular.
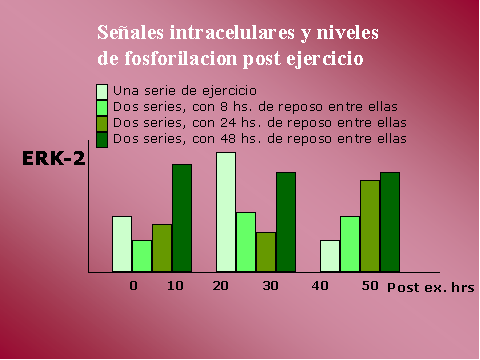
En el caso de ERK-2, vimos que
estaría involucrada en la transcripción y regulación genica.
En p70-S6K, el incremento en la
fosforilacion es significativamente mayor a las 40 hs, luego de dos
sets de ejercicio espaciados en 24 o 48 hs.
En ERK-2, el nivel de
fosforilacion es mayor a las 10 hs. luego de un set de ejercicio,
retornando casi a niveles basales luego de 40 hs. Y en el caso de
dos sets de ejercicio se prolonga durante mas tiempo la activación,
en particular con 48 hs. de reposo entre ambos sets.
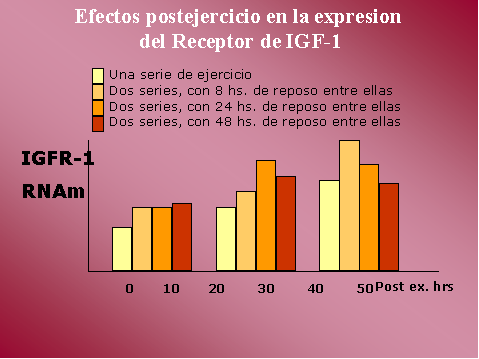
Efectos sobre IGF-1 y su receptor IGFR-1
La expresión de IGF-1, la
transcripción de su RNAm y la traducción a peptido (IGF-1), se
incrementan en la respuesta de hipertrofia compensatoria del músculo
al ejercicio de sobrecarga. Las acciones de IGF-1 reportadas
incluyen la estimulación de la proliferación y diferenciación de
células satélite, así como efectos anabolicos similares a los
producidos por la insulina.
El incremento en los nives de
RNAm de IGF-1 es mayor tanto en magnitud como en duración luego de
dos sets de ejercicio con respecto a un solo set, y mas
significativamente si el intervalo entre los sets es de 24 o 48 hs.

Los niveles de RNAm de IGFR-1 también
se incrementan significativamente y de un modo similar a IGF-1.
Efectos sobre
marcadores de proliferación y diferenciación celular
En el músculo esquelético, como
es sabido, además de células musculares hay células satélite, tejido
conectivo y otras estructuras. Cuando ocurre la hipertrofia
muscular, es necesario un incremento en estas células anexas para
soportar el incremento de tamaño y la mayor capacidad de generar
fuerza de la célula muscular hipertrofiada.
Para que este fenómeno ocurra es
necesario que estas células entren en mitosis, y esto depende de la
etapa del ciclo celular en que se encuentren. El ciclo celular es
regulado en parte por kinasas dependientes de ciclinas (cdk), unas
de ellas son, la ciclina D1 y la miogenina que estimulan a las cdk,
llevando a las células a prepararse para entrar en el ciclo,
volviéndose mitoticamente activas. Estas células anexas así se
diferencian como tales y proliferan durante la hipertrofia muscular.
En este estudio se observo un
incremento en la transcripción de RNAm de ciclina D1 y miogenina,
como así también un incremento paralelo de p21, un inhibidor de cdk.
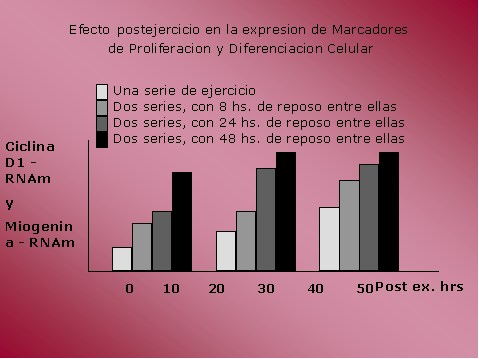
En resumen, el ejercicio de sobrecarga
provoca un
incremento en la fosforilacion, con la consiguiente activación de
diversas proteínas señal intracelulares, como son p70-S6k y ERK-2.
Como así también un incremento en la transcripción del RNAm de IGF-1,
su receptor y marcadores de diferenciación y proliferación celular,
como son ciclina D1 y miogenina.
Este incremento es mayor tanto en
magnitud como en duración luego de 2 sets de ejercicio que luego de
un único set. En cuanto al tiempo de reposo entre los dos sets, en
la mayoría de las respuestas el incremento fue mas significativo con
48 hs de intervalo entre los sets, 24 hs. de reposo también fueron
claramente efectivas, mientras que con 8 hs. el incremento en la
fosforilacion o en RNAm fue inferior. Estos resultados nos sugieren
que los mecanismos que producen estas respuestas (fosforilacion,
transcripción a RNAm) tienen un periodo refractario, dentro del cual
por mas ejercicio que se realice no van a haber incrementos en
ellas.
Con esto vemos la importancia que tiene la frecuencia (intervalo
carga-reposo) en la dosificación del ejercicio de sobrecarga, ya que
varios de los procesos celulares y moleculares que aparecen como
respuesta al ejercicio, son susceptibles a la manipulación de los
parámetros tales como los intervalos carga-reposo, por este camino y
con investigaciones futuras podremos algún día dosificar el
ejercicio de modo tal de optimizar sus resultados.
Conclusión
Esta claro que múltiples
mensajeros y sistemas de señales son activados y desactivados
durante el ejercicio físico y que el grado de activación de cada
proteína su vez es dependiente de múltiples factores en los que se
incluye la intensidad del ejercicio, la duración de este y el tipo
de fibras involucradas en el esfuerzo dejando en claro que otro rol
importante es el lapso de reposo que debería existir entre cada set
de ejercicio. El ejercicio físico sistemático otorga como resultado
múltiples y favorables procesos de adaptación incluyendo proteínas
señales especificas.
En relación a la insulino
resistencia, podemos señalar que en algunos casos se debe a
alteraciones tanto en el receptor mismo de insulina o en las
primeras proteínas señal (IRS-1, PI3K) de su cascada de transduccion
y podríamos aventurarnos a afirmar que es causa del
desencadenamiento de la posterior diabetes tipo II que también
puede estar causada por defectos en la transduccion de señales
correspondientes al transporte de glucosa en el músculo esquelético.
El ejercicio físico ha sido
identificado como un activador fisiológico del transporte de glucosa
independientemente de insulina, incrementando la expresión de genes
y activando el transporte de glucosa por una vía independiente
apoyada básicamente en la translocacion de GLUT4 lo que tiene un
implicancia terapéutica muy importante en el control de la
homeostasis de la glucosa en pacientes diabéticos insulino
resistentes.
Finalmente a todo lo
señalado anteriormente no debemos dejar de mencionar que fenómenos
que podríamos denominar “gatilladores de base” serian el inductor de
la optimización de las señales, nos referimos a la deplecion de los
depósitos de glucógeno y al incremento en la perfusion capilar como
a si mismo la movilización y metabolizacion de los triglicéridos
intramusculares.
Lecturas recomendadas
Kei Sakamoto, Laurie J.
Goodyear.: Intracellular signaling in contracting skeletal muscle.
J. Appl. Physiol. 2002;
93: 369-83.(con 160 referencias)
Jorgen F. P.
Wojtaszewski, Jakob N. Nielsen, Erik A. Richter.: Effect of acute
exercise on insulin signaling and action in humans.
J. Appl. Physiol. 2002; 93:
384-92.(con 90 referencias)
Fadia Haddad, Gregory R.
Adams Acute cellular and molecular responses to resistance exercise.
J. Appl. Physiol. 2002;
93: 394-402.(con 62 referencias)
J.W. Ryder, A.V. Chibalin, J.R.
Zierath. Intracellular mechanisms underlying increases in glucose
uptake in response to insulin or exercise in skeletal muscle.
Acta Physiol. Scand. 2001; 171: 249-57.
(con 140
referencias)
Kennedy J.W., Hirshman
M.F.,Gervino E.V.,Ocel J.V., Forse R.A., Hoenig S.J., Aronson D.,
Goodyear. Acute Exercise Induces GLUT4 Translocation in Skeletal
Muscle of Normal Human Subjects and Subjects With Type 2 Diabetes.
Diabetes.
1999; 48: 1192-97.(con
56 referencias)
J.R. Daugaard, E.A. Richter.
Relationship between muscle fibre composition, glucose transporter
protein 4 and exercise training: possible consequences in
non-insulin-dependent diabetes mellitus. Acta Physiol.
Scand. 2001; 171: 267-76.(con
136 referencias)
|
















